Phosphat ist ein essenzieller Nährstoff für alle Lebewesen. Gleichzeitig sind seine Ressourcen auf der Erde begrenzt und nicht erneuerbar – Schätzungen zufolge können die zur Herstellung von Düngern geeigneten Phosphatvorkommen in den kommenden 300 Jahren aufgebraucht sein. Wenn von Phosphat die Rede ist, dürfte aber noch ein weiteres Problem in einigen Köpfen auftauchen: In der Landwirtschaft eingesetztes Phosphat kann durch seine Weitergabe in Gewässer dazu führen, dass aquatische Ökosysteme, also Flüsse, Seen und Ozeane, akut bedroht werden. Der Grund: Ein erhöhter Nährstoffgehalt in den Gewässern, Eutrophierung genannt, kann zu übermäßigem Algenwachstum und schließlich zu Sauerstoffmangel in den Ökosystemen führen.
Würde man es schaffen, Phosphat in der Landwirtschaft ohne negative Auswirkungen auf die Erträge zu reduzieren, hätte das also zwei Vorteile. Zum einen könnte am Abbau von Phosphat gespart werden, zum anderen würde weniger Phosphat in die Ökosysteme wie Seen und Meere gelangen. Um das zu erreichen, arbeiten Forschende an Strategien, Nutzpflanzen phosphateffizienter zu machen. Das bedeutet, dass die Pflanzen Phosphat besser mobilisieren, aufnehmen und bei Bedarf recyceln können.
Pflanzen überwachen ihre Phosphatreserven
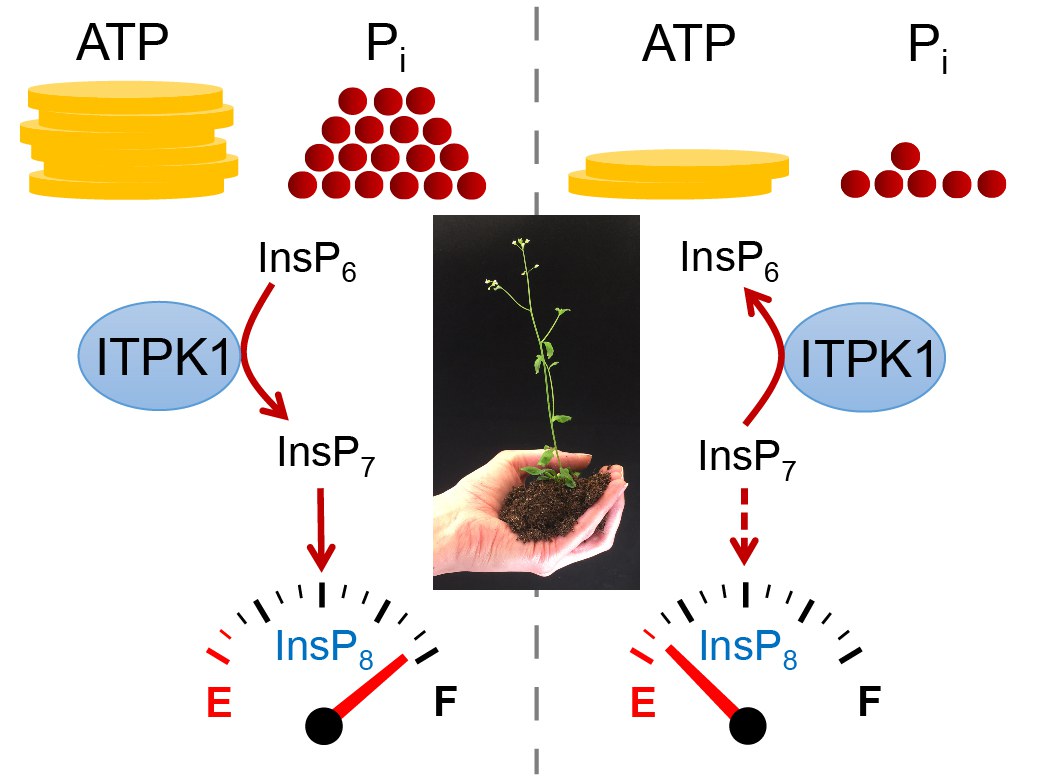
Weitestgehend unbekannt sind bisher die genauen Mechanismen, mit denen Pflanzen und andere Organismen erkennen, ob Phosphat in ausreichender Menge vorliegt oder ob sie Phosphat aufnehmen und mobilisieren müssen. Forschende entdeckten vor einiger Zeit, dass Pflanzen Phosphat nicht direkt wahrnehmen, sondern indirekt mithilfe des Signalmoleküls InsP8 aus der Stoffgruppe der Inositolpyrophosphate. Sogenannte SPX-Proteine helfen dabei. „Diese Ergebnisse deuten darauf hin, dass Inositolpyrophosphate wie InsP8 indirekt den Gesamtzustand des Pflanzenphosphats anzeigen“, sagt Dr. Ricardo Giehl vom Leibniz-Institut für Pflanzengenetik und Kulturpflanzenforschung (IPK).
Allerdings war bisher unklar, wie Pflanzen InsP8 und dessen Vorstufe InsP7 produzieren. Um dieser Frage auf den Grund zu gehen, nutzte das Bonner Forscherteam bereits in einer vorherigen Studie einen genetischen Trick: In Bäckerhefe exprimierten die Wissenschaftlerinnen und Wissenschaftler hierfür in Frage kommende Kinasen – also Enzyme, die einen Phosphatrest vom sogenannten ATP, dem universellen Energieträger der Zelle, auf andere Substrate übertragen. Auf diese Weise identifizierten die Forschenden, dass die InsP6-Kinase ITPK1 die wichtigen Signalmoleküle in Gang setzt.
In der neuen Studie konnten sie zeigen, dass das Enzym ITPK1 in der Pflanze tatsächlich als InsP6-Kinase aktiv ist und für die Synthese des Isomers 5-InsP7 als direkte Vorstufe von InsP8 verantwortlich ist. Darüber hinaus fanden die Forschenden heraus, dass die Stoffgruppe, zu denen die Signalmoleküle gehören (Inositolpyrophosphate), sehr empfindlich auf Phosphat reagiert und diese von ihr ausgehende Regulation nicht nur in unterschiedlichen Pflanzen (einschließlich Moosen), sondern auch in menschlichen Zellen stattfindet.
„Da Inositolpyrophosphate sehr instabil sind, konnten wir sie mithilfe einer neu entwickelten Methode erst vor wenigen Jahren in Pflanzen nachweisen“, erklärt Esther Riemer vom Institut für Nutzpflanzenwissenschaften und Ressourcenschutz (INRES) der Universität Bonn und Erstautorin der Studie. „ITPK1 kann in Abhängigkeit des zellulären Energie-Status und damit indirekt auch in Abhängigkeit der Phosphatversorgung die Synthese von InsP8 einleiten, wodurch unter anderem die Phosphataufnahme gehemmt wird. Außerdem kann es als sogenannte ATP-Synthase wirken, um letztendlich das InsP8-Signal abzuschalten und damit die Phosphataufnahme zu aktivieren“, sagt Dr. Ricardo Giehl.
Mithilfe einer neuen massenspektrometrischen Methode, entwickelt vom Forscherteam von Prof. Dr. Henning Jessen vom Institut für Organische Chemie der Universität Freiburg, identifizierten die Wissenschaftler zudem neue pflanzliche Inositolpyrophosphate. „Darunter ist unter anderem das Isomer 4/6-InsP7. Auch wenn dessen Funktion noch unbekannt ist, scheint es nicht an der Regulation von Phosphatmangel-Antworten beteiligt zu sein“, sagt Esther Riemer.
Auf dem Weg zur nachhaltigen Nutzpflanzenproduktion
„Die Ergebnisse dieser und weiterer Studien haben weitreichende Konsequenzen für unser Verständnis, wie Organismen Phosphatmangel erkennen und wie physiologische Antworten in Abhängigkeit des Energiestatus generiert werden“, sagt Prof. Dr. Gabriel Schaaf vom INRES der Universität Bonn. „Unsere Arbeit liefert darüber hinaus wichtige Erkenntnisse, wie Nutzpflanzen durch neue Züchtungsmethoden, zum Beispiel durch Genomeditierung Phosphat-effizienter gemacht und dadurch umweltfreundlicher und ressourcenschonender angebaut werden können.“
Gabriel Schaaf ist Mitglied des Exzellenzclusters „PhenoRob – Robotik und Phänotypisierung für Nachhaltige Nutzpflanzenproduktion“ und des Transdisziplinären Forschungsbereichs „Innovation und Technologie für eine nachhaltige Zukunft“ der Universität Bonn.
Gemeinsame Pressemitteilung der Universität Bonn und des Leibniz-Instituts für Pflanzengenetik und Kulturpflanzenforschung (IPK)